

Química 2ª Série
Aula 01: Mol e o Cálculo Estequiométrico
O conteúdo desta Aula foi elaborado com base no Livro:
Mol:unidade de medida para a quantidade de matéria, ou seja, átomos, moléculas, elétrons etc. É
O físico italiano Lorenzo Romano Amedeo Carlo Avogadro (1776-1856) propôs que, sob mesma temperatura e pressão, volumes iguais de gases diferentes possuem a mesma quantidade de moléculas.
Estipulou-se a constante de Avogadro (\(N_A\)), que representa a quantidade de matéria presente em 1 mol e tem valor numérico igual a: \(1 mol = 6,02214076 \cdot 10^{23}\)
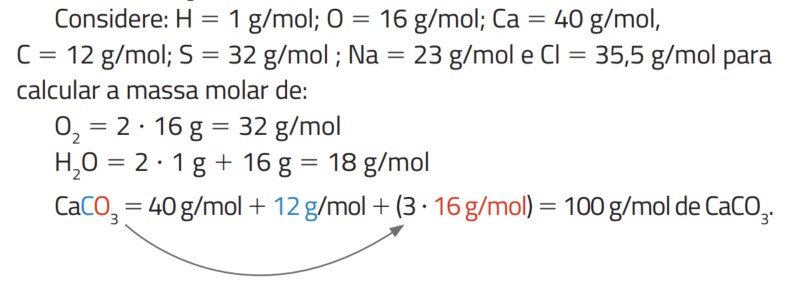
A massa molar (M) é a massa de 1 mol de partículas, sejam elas átomos, moléculas, elétrons etc., e é expressa em g/mol. É calculada a partir da massa molar de seus constituintes:
Exemplo: O carbonato de cálcio \((C_aCO_3)\) tem a seguinte massa molar:
Calcule:
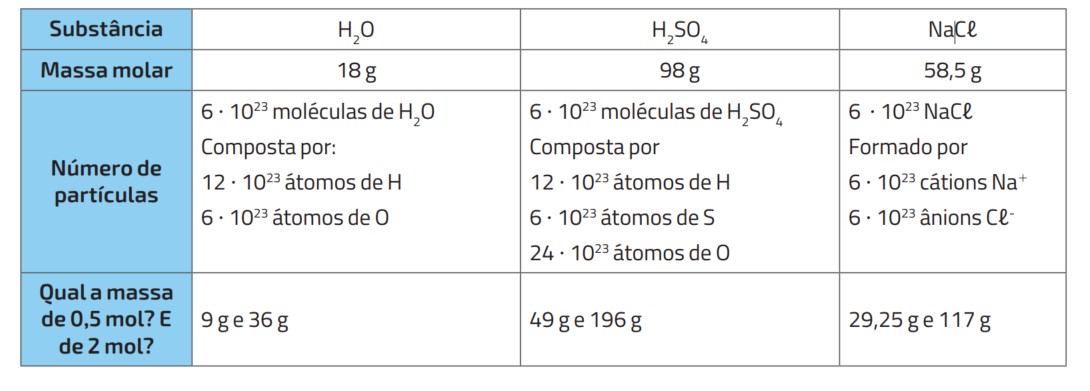
a massa de 0,25 mol de \(H_2O\).
a quantidade de matéria (mol) em 980g de Ácido sulfúrico (\(H_2SO_4\))
Para calcular a massa de determinado elemento é só multiplicar a atomicidade do elemento pela massa e somar com os demais elementos.
\[H_2O = 18g \; (2 \cdot 1 + 16 = 18)\]
\[ 1 \; mol \; de \; H_2O \longrightarrow 18 g \;de \;H_2O\]
\[0,25 \; mol \;de \;H_2O \longrightarrow x g \;de \;H_2O\]
\[x = 4,5 g \; de\; H_2O\]
Portanto a massa em gramas de 0,25 mol de \(H_2O\) é 4,5 gramas
Massa molar do \(H_2SO_4\):
\[H_2SO_4 = 1 \cdot 2 + 32 + 16 \cdot 4 = 98 \; g/mol{-1}\]
\[1 \;mol \;de \;H_2SO_4 \longrightarrow 98 \;g\]
\[x \;mol \;de \;H_2SO_4 \longrightarrow \;980 \;g\]
\[x = \frac{980}{98} = 10\]
x = 10 mols de \(H_2SO_4\)
As equações químicas representam os processos de transformações de reagentes em produtos e sempre devem ser balanceadas obedecendo as leis de Lavoisier e Proust.
Por meio de um experimento feito em sistema fechado Lavoisier (1743-1794) percebeu que a massa dos reagentes e dos produtos se conservava. Na mesma época, o químico francês Joseph Louis Proust (1754-1826) enunciou que as reações químicas acontecem em proporções definidas.
A equação química de síntese de água a partir de gás oxigênio e gás hidrogênio, por exemplo, pode ser expressa da seguinte forma: 2 mol de moléculas de gás hidrogênio reagem com 1 mol de moléculas de gás oxigênio formando 2 mol de moléculas de água.
Equação: \[2H_2 + 1O_2 \to 2H_2O\]
Massa: \[2 \cdot 2g + 1 \cdot 32g \to 2 \cdot 18g\]
Os valores na frente das substâncias são chamados de coeficientes estequiométricos da equação;
Para estabelecer uma relação entre as quantias de reagentes e produtos de uma reação química alguns passos são essenciais;
Passo 1: Escreva a equação química;
Passo 2: Faça o balanceamento da equação ajustando os coeficientes para que reagentes e produtos tenham a mesma quantidade de átomos (Lei de Proust e Lei de Lavoisier);
Passo 3: Identifique o que se pede no problema e escreva os valores das substâncias, seguindo os dados do problema.
Passo 4: Estabeleça a relação existente entre os números de mol, massa, no de partículas ou volume para substâncias gasosas.
Relação de massa com massa: Equacione a reação de combustão do carbono e determine a massa de gás carbônico formada quando utilizamos 6 g de carbono e quantidade de oxigênio suficiente. Dados: C = 12 g/mol; O = 16 g/mol

Relação de massa com mol: Para reagir com 1 mol de hidróxido de sódio \((NaOH)\), qual a massa de ácido sulfúrico \((H_2SO_4)\) necessária para que a neutralização seja total? Dados: C = 12 g/mol; O = 16 g/mol

Rendimento: Um laboratorista minucioso usou 5 mol de gás hidrogênio e 2,5 mol de gás oxigênio para sintetizar água, obtendo, ao final do experimento, 4 mol de vapor-d’água. Calcule a quantidade de água que teoricamente deveria ser formada a partir das quantidades de reagentes utilizadas e, em seguida, o rendimento da reação.

A amônia (NH3) é um composto químico que pode ser produzido pela reação entre os gases nitrogênio (N2) e hidrogênio (H2), conforme a reação não balanceada a seguir: \(X N_{2(g)} + Y H_{2(g)} \to Z NH_{3(g)}\). Quais são os coeficientes estequiométricos X, Y, Z dos compostos apresentados na equação química? Lembre-se: Para a equação estar correta deve-se ter o mesmo número de átomos nos reagentes e nos produtos.
Para a reação de síntese da amônia (NH3) ao utilizar 10 g de nitrogênio (N2) reagindo com hidrogênio (H2), qual massa, em gramas, do composto é produzida? Dados: N: 14 g/mol e H: 1 g/mol.